研究者利用DART-seq技術��,通過APOBEC1-YTH融合蛋白在活細胞中誘導m6A位點附近的C-to-U突變���,以實現(xiàn)單核苷酸分辨率的m6A識別�。研究發(fā)現(xiàn)��,這些C-to-U突變并非集中于m6A鄰近位置,而傾向于在距離m6A位點100 nt范圍內聚集成簇�。那么這些距離在10100nt范圍內的突變能夠用于標記m6A位點,而不會干擾ONT DRS中m6A甲基化5-mer的電流信號�?��;?/span>這種內源性標記策略�����,研究團隊利用在ONT DRS數(shù)據(jù)中提取了1,020,237個讀長水平的5-mer m6A信號��,并結合深度殘差神經網絡����,成功開發(fā)了能夠在單條讀長水平上識別m6A的工具m6Aiso����。此外,研究者還采用了真邁生物的SURFSeq 5000平臺完成了A549細胞系的GLORI測序����,為m6Aiso 在多個細胞系中的準確性評估提供了有力的支撐,同時也反映了SURFSeq 5000平臺進行二代高通量測序具有高度的可靠性����。如下圖所示,研究團隊在多個細胞系中比較了m6Aiso以及GLORI測序得到的m6A修飾水平�,m6Aiso在HEK293T, HeLa, A549, mESC中都和GLORI高度一致�,其中HEK293T, HeLa和 mESC的GLORI數(shù)據(jù)來源于原始的GLORI論文,而A549細胞的GLORI數(shù)據(jù)為團隊自行建庫后采用SURFSeq 5000平臺完成的測序�。
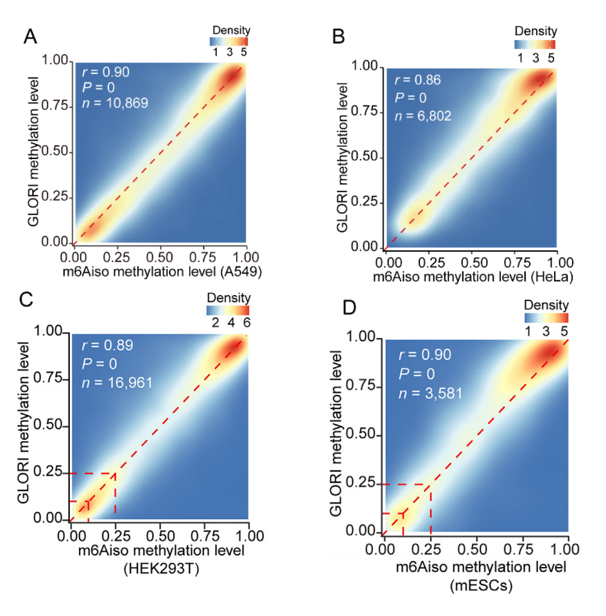
圖1 不同細胞系m6Aiso和GLORI測序得到的m6A修飾水平比較
利用工具m6Aiso,研究者闡述了相同m6A位點不同的異構體上形成差異化m6A修飾的三種機制:1�、EJC(外顯子連接復合體)對m6A抑制的差異,與之前的研究一致����,發(fā)現(xiàn)EJC會抑制靠近外顯子邊界的m6A沉積,即在異構體中外顯子邊界200 bp范圍內的m6A甲基化水平較低�;2、RNA結合蛋白對不同異構體RNA的特異性結合�,如TARBP2結合內含子的鄰近外顯子上的m6A位點的甲基化水平顯著高于未結合TARBP2內含子的鄰近外顯子;3����、轉錄因子也會調控m6A,主要通過共轉錄的方式招募m6A 的甲基化轉移酶來修飾其轉錄的RNA��,因此使用不同啟動子的RNA由于轉錄因子不同而產生差異的m6A修飾��。由于變化的m6A位點位于共同的3'UTR�,而短讀長測序無法確定每個亞型的具體5'區(qū)域,因此這一發(fā)現(xiàn)進一步強調了在研究m6A動態(tài)變化時使用長讀長測序的必要性。
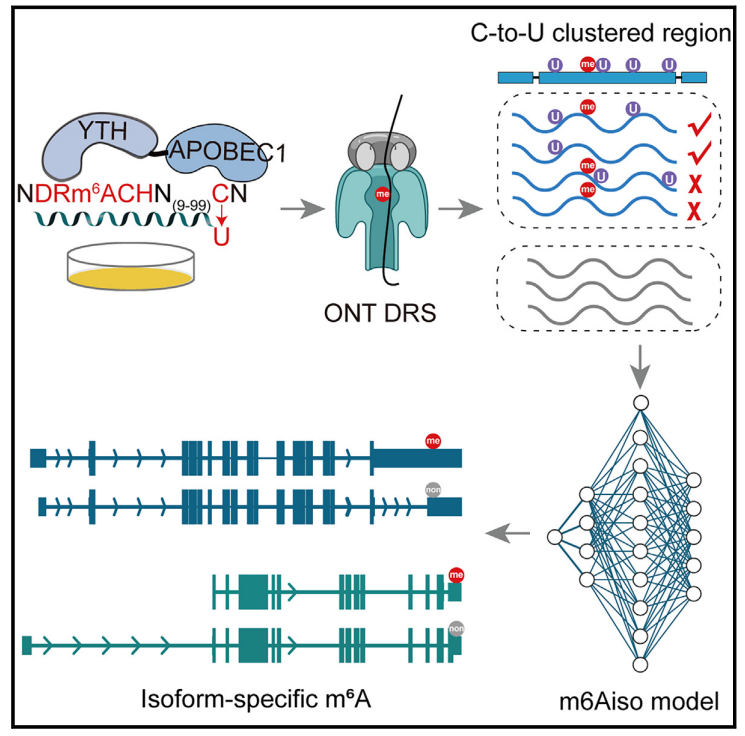
圖2 m6A在單reads上的內源性標記和m6Aiso在單分子水平上的結果評價