近日,廣州國(guó)家實(shí)驗(yàn)室范小英教授團(tuán)隊(duì)在Cell Reports(IF 7.5)上發(fā)表了題為“Identification of the core regulatory program driving NEUROD1-induced neuronal reprogramming”的研究成果�����。研究人員建立了大鼠皮層星形膠質(zhì)細(xì)胞體外重編程系統(tǒng)��,通過(guò)單細(xì)胞與多組學(xué)測(cè)序技術(shù)(scRNA-seq、ATAC-seq���、Cut&Tag和bulk RNA-seq)系統(tǒng)解析了轉(zhuǎn)錄因子NEUROD1(ND1)驅(qū)動(dòng)星形膠質(zhì)細(xì)胞(Ast)向神經(jīng)元(Neu)轉(zhuǎn)分化的動(dòng)態(tài)軌跡與分子機(jī)制�����。研究發(fā)現(xiàn)ND1作為先鋒因子通過(guò)誘導(dǎo)H3K27ac組蛋白修飾重塑染色質(zhì)開(kāi)放性�,激活包括Hes6在內(nèi)的25個(gè)關(guān)鍵調(diào)控靶點(diǎn)����,其重編程過(guò)程高度模擬了體內(nèi)皮層神經(jīng)發(fā)生��。這項(xiàng)研究不僅闡明了星形膠質(zhì)細(xì)胞向神經(jīng)元轉(zhuǎn)分化過(guò)程中的獨(dú)特中間態(tài)細(xì)胞及核心調(diào)控網(wǎng)絡(luò)�����,更為神經(jīng)損傷修復(fù)和退行性疾病的治療提供了革命性策略�����。本研究采用真邁生物SURFSeq 5000平臺(tái)完成高質(zhì)量的轉(zhuǎn)錄組測(cè)序分析�。
成年哺乳動(dòng)物大腦的神經(jīng)再生能力極為有限��,僅在海馬齒狀回和側(cè)腦室下區(qū)等特定區(qū)域維持微弱再生能力����,且新生神經(jīng)元數(shù)量極其有限。傳統(tǒng)外源細(xì)胞移植療法長(zhǎng)期面臨細(xì)胞存活率低����、功能整合差等瓶頸問(wèn)題。在這一背景下�����,星形膠質(zhì)細(xì)胞展現(xiàn)出獨(dú)特的治療潛力���。作為大腦內(nèi)數(shù)量最龐大的膠質(zhì)細(xì)胞群體���,它們不僅分布廣泛�����,更在損傷后表現(xiàn)出類似神經(jīng)干細(xì)胞(NSCs)的再生特性。這些特性使其成為內(nèi)源性神經(jīng)再生的理想“細(xì)胞寶庫(kù)”����。近年研究表明,通過(guò)特定干預(yù)手段可顯著提升膠質(zhì)細(xì)胞的神經(jīng)轉(zhuǎn)化效率��,包括異位表達(dá)促神經(jīng)元轉(zhuǎn)錄因子����,如NEUROD1(ND1);microRNA 干擾����;PTBP1(一種重要的RNA結(jié)合蛋白)基因敲除;小分子化合物處理�����。作為神經(jīng)發(fā)育過(guò)程中的先鋒轉(zhuǎn)錄因子(TF),ND1具有快速誘導(dǎo)神經(jīng)元表型的獨(dú)特能力�����,但其動(dòng)態(tài)調(diào)控網(wǎng)絡(luò)仍待闡明�。過(guò)往研究依賴于bulk RNA-seq,無(wú)法解析重編程過(guò)程中的細(xì)胞異質(zhì)性和多階段分子事件��。本研究建立無(wú)內(nèi)源性神經(jīng)元干擾的體外ND1重編程系統(tǒng)�����,通過(guò)單細(xì)胞轉(zhuǎn)錄組(scRNA-seq)�、染色質(zhì)可及性(ATAC-seq)和組蛋白修飾分析,揭示ND1驅(qū)動(dòng)星形膠質(zhì)細(xì)胞向神經(jīng)元轉(zhuǎn)化的動(dòng)態(tài)調(diào)控網(wǎng)絡(luò)�,為理解神經(jīng)再生機(jī)制提供了新的理論框架。
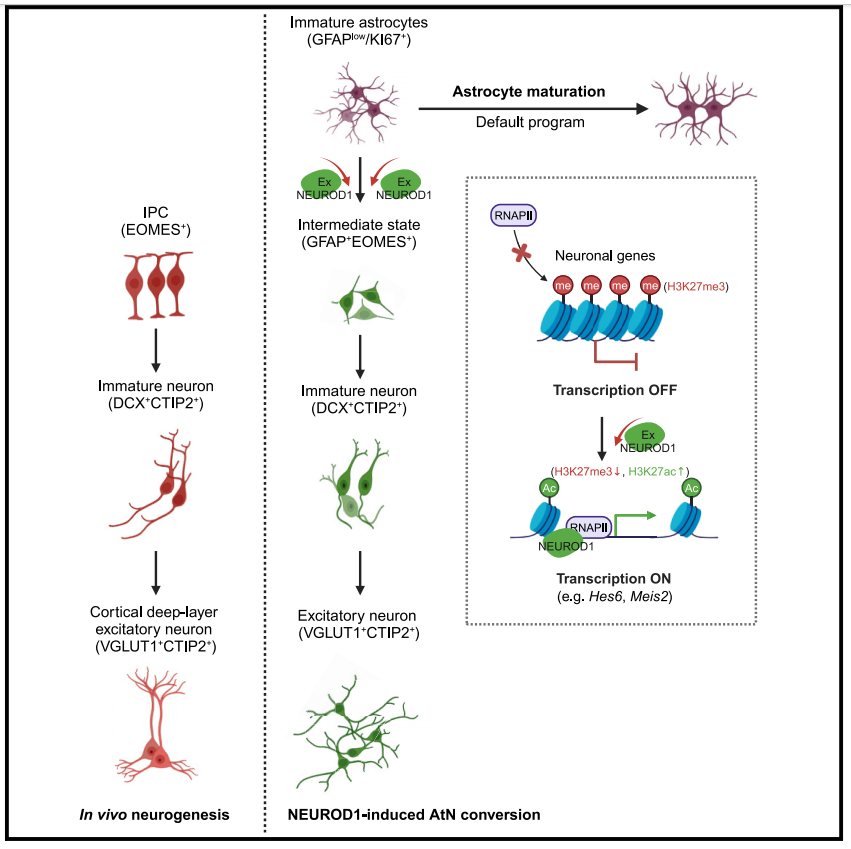
單細(xì)胞RNA測(cè)序揭示ND1誘導(dǎo)神經(jīng)元重編程過(guò)程中多樣化的中間細(xì)胞狀態(tài)
為探究ND1誘導(dǎo)星形膠質(zhì)細(xì)胞向神經(jīng)元轉(zhuǎn)分化(AtN)的細(xì)胞機(jī)制��,研究團(tuán)隊(duì)建立了體外轉(zhuǎn)分化研究體系�。利用新生大鼠大腦皮層分離的原代星形膠質(zhì)細(xì)胞,通過(guò)逆轉(zhuǎn)錄病毒感染實(shí)現(xiàn)ND1的穩(wěn)定過(guò)表達(dá)��。研究結(jié)果顯示:在ND1過(guò)表達(dá)第三天時(shí)�,經(jīng)典神經(jīng)元標(biāo)志物TUJ1開(kāi)始表達(dá)。隨后��,通過(guò)對(duì)0-5天這一關(guān)鍵轉(zhuǎn)換期的scRNA-seq分析揭示了細(xì)胞命運(yùn)決定的動(dòng)態(tài)過(guò)程。完成數(shù)據(jù)過(guò)濾后�,0天組捕獲了13,081個(gè)細(xì)胞,GFP對(duì)照組32,741個(gè)細(xì)胞���,ND1過(guò)表達(dá)組46,164個(gè)細(xì)胞�����。研究者共鑒定出三種主要細(xì)胞類型:未成熟星形膠質(zhì)細(xì)胞(ImA)、成熟星形膠質(zhì)細(xì)胞(Astrocyte)和神經(jīng)元細(xì)胞(Neuron)��。其中ImA可進(jìn)一步分為三個(gè)亞群:增殖態(tài)ImA_div�、靜息態(tài)ImA以及高表達(dá)ND1的ImA_ND1_hi,這些亞群均高表達(dá)Gfap與Tnc�。Astrocyte也包含三個(gè)亞群:高表達(dá)Gfap/Tnc/Col11a1的Ast_1,以及高表達(dá)Atp1a2/Aqp4的Ast_2與Ast_3�����。神經(jīng)元分為4個(gè)亞群(Neu_1至Neu_4)��,均高表達(dá)神經(jīng)元標(biāo)志基因�����,且功能富集于軸突發(fā)生,樹(shù)突發(fā)育���,神經(jīng)元遷移�,以及細(xì)胞突起調(diào)控等神經(jīng)相關(guān)通路����。隨著時(shí)間推移,細(xì)胞類型發(fā)生明顯變化:0天時(shí)���,80%細(xì)胞為ImA��,GFP對(duì)照組主要為ImA和Astrocyte��,而ND1過(guò)表達(dá)組大部分細(xì)胞(52.5%)轉(zhuǎn)分化為神經(jīng)元�����。第14天時(shí)�,80%的GFP+星形膠質(zhì)細(xì)胞轉(zhuǎn)為TUJ1+神經(jīng)元���,且超過(guò)90%為VGLUT1+興奮性神經(jīng)元���,其中TBR1+與CTIP2+細(xì)胞占比較高�。30天時(shí)��,轉(zhuǎn)分化的神經(jīng)元已具備類似胚胎16.5天大鼠皮層神經(jīng)元的電生理特性�,主要形成功能性興奮性神經(jīng)環(huán)路,其放電頻率與振幅與原代神經(jīng)元相當(dāng)��。這些結(jié)果證實(shí)了ND1能在大鼠星形膠質(zhì)細(xì)胞中實(shí)現(xiàn)快速高效的體外神經(jīng)元重編程����,首次揭示了通過(guò)ImA_ND1_hi過(guò)渡態(tài)的轉(zhuǎn)分化軌跡,明確了神經(jīng)元轉(zhuǎn)分化過(guò)程中的連續(xù)細(xì)胞狀態(tài)�。
圖1?ND1誘導(dǎo)AtN過(guò)程中的細(xì)胞類型多樣性
確定ND1誘導(dǎo)的神經(jīng)元重編程過(guò)程中的核心調(diào)控基因
通過(guò)整合多種ND1驅(qū)動(dòng)的神經(jīng)元分化系統(tǒng)���,研究者對(duì)ND1的ChIP-seq數(shù)據(jù)集進(jìn)行了重新分析�,并與本研究的AtN體系Cut&Tag數(shù)據(jù)進(jìn)行了系統(tǒng)比較��。研究團(tuán)隊(duì)共鑒定出40個(gè)跨系統(tǒng)保守的ND1直接靶基因(包括已知的Hes6,?Mfap4,?Smad3等)�����,這些基因顯著富集于神經(jīng)系統(tǒng)發(fā)育相關(guān)通路�。基于scRNA-seq數(shù)據(jù)構(gòu)建的基因調(diào)控網(wǎng)絡(luò),進(jìn)一步將靶基因范圍縮小至25個(gè)與ND1表達(dá)密切相關(guān)的關(guān)鍵調(diào)控因子�,其中20個(gè)基因顯著上調(diào),證實(shí)ND1在AtN過(guò)程中主要發(fā)揮轉(zhuǎn)錄激活作用�;同時(shí)發(fā)現(xiàn)5個(gè)下調(diào)的星形膠質(zhì)細(xì)胞相關(guān)基因,提示ND1還具有直接抑制膠質(zhì)細(xì)胞特性的功能�����。轉(zhuǎn)錄因子活性分析顯示���,Hes6和Smad3在AtN過(guò)程中活性發(fā)生顯著改變����,本研究新發(fā)現(xiàn)的靶點(diǎn)Meis2在轉(zhuǎn)化細(xì)胞中表現(xiàn)出顯著的TF活性增強(qiáng)���。為驗(yàn)證這些核心調(diào)控因子的功能�,研究者通過(guò)shRNA對(duì)Hes6和Meis2進(jìn)行了敲低��,并結(jié)合真邁生物SURFSeq 5000平臺(tái)的bulk RNA-seq分析轉(zhuǎn)錄組水平的變化����。Hes6敲低導(dǎo)致晚期神經(jīng)發(fā)生基因(如Tubb3、Slc1a�、Slc17a7)顯著上調(diào),同時(shí)伴隨TUJ1+/GFAP+雙陽(yáng)性細(xì)胞比例增加,提示Hes6通過(guò)防止神經(jīng)元基因過(guò)早激活來(lái)確保轉(zhuǎn)分化的時(shí)序性�。Meis2敲低顯著降低內(nèi)源ND1表達(dá)及其調(diào)控的神經(jīng)元發(fā)生基因,降低轉(zhuǎn)分化效率�����,表明Meis2通過(guò)維持ND1的表達(dá)從而驅(qū)動(dòng)完整的神經(jīng)元重編程�。這些發(fā)現(xiàn)不僅揭示了ND1通過(guò)共同的核心靶基因網(wǎng)絡(luò)調(diào)控神經(jīng)元分化的分子基礎(chǔ),還闡明了Hes6和Meis2在AtN中的作用機(jī)制���。
圖2?參與神經(jīng)元重編程的關(guān)鍵ND1靶點(diǎn)
1.?ND1誘導(dǎo)的ImA-to-neuron轉(zhuǎn)分化過(guò)程瞬時(shí)激活星形膠質(zhì)細(xì)胞和神經(jīng)元的基因�;
2.?ND1誘導(dǎo)的神經(jīng)元重編程軌跡模擬體內(nèi)神經(jīng)發(fā)生過(guò)程�����;
3.?ND1通過(guò)誘導(dǎo)H3K27ac修飾快速改變ImA的開(kāi)放染色質(zhì)景觀���;
4.?鑒定出25個(gè)ND1關(guān)鍵靶基因(包括Hes6,Meis2)作為核心調(diào)控因子����。
Li, Wen, et al. "Identification of the core regulatory program driving NEUROD1-induced neuronal reprogramming." Cell Reports 44.4 (2025).